|
|
|
|
|
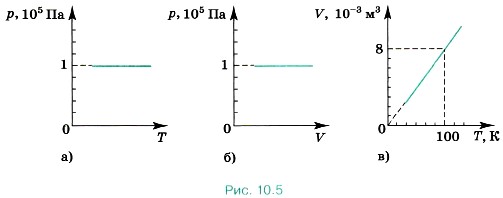
Глава 10. Уравнение состояния идеального газа. Газовые законы § 67. Примеры решения задач по теме «Определение параметров газа по графикам изопроцессов»При решении многих задач на газовые законы требуется построение графиков, изображающих разного рода процессы. На графиках обозначаем точки, определяющие состояния системы. Имеем в виду, что можно изобразить только равновесные процессы, при которых каждое промежуточное состояние равновесное, т. е. температура и давление одинаковы во всех точках данного объёма. Задача 1. Постройте изобары для водорода массой 2 г при нормальном атмосферном давлении р0 в координатах р, Т; р, V; V, Т. Р е ш е н и е. На графиках зависимости р от Т и р от V изобара представляет собой прямую, параллельную либо оси Т, либо оси V (рис. 10.5, а и б). Так как
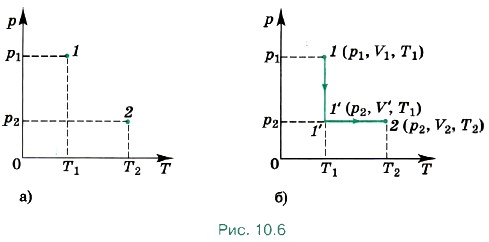
Задача 2. Выведите уравнение Клапейрона при переходе газа из состояния 1 (Р1, V1, Т1) в состояние 2 (р2, V2, Т2) (рис. 10.6, а). Р е ш е н и е. Переведём газ из состояния 1 в состояние 2, совершив два процесса: изотермический из состояния 1 в состояние 1', поддерживая постоянную температуру T1, и изобарный из состояния 1' в состояние 2, поддерживая постоянным давление р2 (рис. 10.6, б).
Согласно закону Бойля—Мариотта запишем: P1V1 = p2V', согласно закону Гей-Люссака
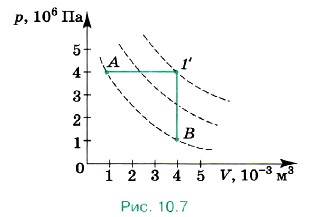
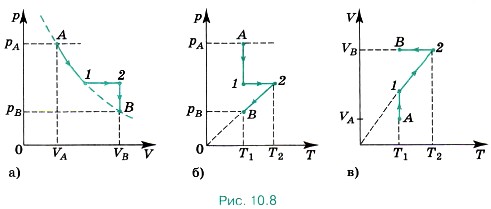
Задача 3. На графике (рис. 10.7) показан переход газа, взятого в количестве 2 моль, из состояния А в состояние В. Определите изменение температуры газа, а также максимальное значение температуры при этом переходе. Р е ш е н и е. По графику видно, что сначала газ нагревался при постоянном давлении, а затем давление уменьшалось при постоянном объёме, при этом температура уменьшалась. Обратим внимание на то, что произведение давления на объём в состояниях А и В одно и то же и равно 4000 Па • м3. Согласно закону Менделеева—Клапейрона Начертим изотермы, проходящие через отмеченные состояния. Согласно графикам максимальная температура соответствует промежуточному состоянию 1', для которого V = 4 л, а давление 4 • 106 Па. Тогда Т = 962 К. Задача 4. На рисунке (10.8, а) изображён график перехода газа из состояния А в состояние В в координатах р, V. Постройте график этого перехода в координатах р, Т и V, Т.
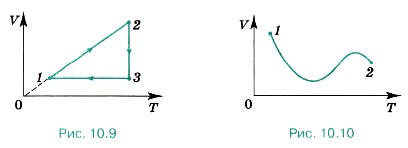
Р е ш е н и е. Сначала построим график перехода в координатах р, Т. Поставим точку, соответствующую состоянию А газа (рис. 10.8, б). Процесс А—1 изотермический. При этом давление газа уменьшается. Процесс 1—2 изобарный. Построим отрезок, параллельный оси абсцисс. Процесс 2—В изохорный, при этом температура газа уменьшается. Начертим изохору, проходящую через точку 2. Конечное состояние соответствует давлению рB. Аналогично строим переход в координатах V, Т (рис. 10.8, в). При процессе А—1 объём газа увеличивается при постоянной начальной температуре. При процессе 1—2 объём увеличивается при постоянном давлении. Изобара проходит через начало координат. Конечное состояние соответствует объёму VB. Затем процесс изохорный, при этом температура газа понижается. Задачи для самостоятельного решения1. Постройте изохоры для кислорода массой 16 г и объёмом 1 л в координатах р, V; V, Т и р, Т. 2. На рисунке 10.9 представлен график изменения состояния идеального газа в координатах V, Т. Представьте этот процесс на графиках в координатах р, V и р, Т. 3. Газ перешёл из состояния 1 в состояние 2 (рис 10.10). Масса газа постоянна. Как изменилось давление газа? 4. Начертите графики зависимости плотности газа от температуры при изобарном процессе и плотности газа от давления при изохорном процессе. Масса газа постоянна.
Повторите материал главы ю по следующему плану1. Выпишите основные понятия и физические величины и дайте им определение. 2. Сформулируйте законы и запишите основные формулы. 3. Укажите единицы физических величин и их выражение через основные единицы СИ. 4. Опишите основные опыты, подтверждающие справедливость законов.
|
|
|



 то графиком зависимости V от Т является прямая, проходящая через начало отсчёта. Учитывая, что m = 0,002 кг, М = 0,002 кг/моль, R = 8,31 Дж/(моль • К) и р0 = 105 Па, можно записать: V = ВТ, где
то графиком зависимости V от Т является прямая, проходящая через начало отсчёта. Учитывая, что m = 0,002 кг, М = 0,002 кг/моль, R = 8,31 Дж/(моль • К) и р0 = 105 Па, можно записать: V = ВТ, где  В частности, при Т = 100 К V ≈ 8 • 10-3 м3. График зависимости V от Т показан на рисунке (10.5, в).
В частности, при Т = 100 К V ≈ 8 • 10-3 м3. График зависимости V от Т показан на рисунке (10.5, в).
 Выразив из первого и второго уравнений V' и приравняв правые части полученных равенств, запишем:
Выразив из первого и второго уравнений V' и приравняв правые части полученных равенств, запишем:
 Перенеся параметры с индексом 1 в левую часть, а параметры с индексом 2 в правую, получим уравнение Клапейрона
Перенеся параметры с индексом 1 в левую часть, а параметры с индексом 2 в правую, получим уравнение Клапейрона  Для вывода уравнения мы использовали два экспериментально установленных закона: изотермический и изобарный.
Для вывода уравнения мы использовали два экспериментально установленных закона: изотермический и изобарный.
 ΔТ = 0.
ΔТ = 0.




 «Основное уравнение МКТ и основное уравнение состояния идеального газа»
«Основное уравнение МКТ и основное уравнение состояния идеального газа»
 «Экспериментальное подтверждение газовых законов (схемы опытов, предложенные вами)»
«Экспериментальное подтверждение газовых законов (схемы опытов, предложенные вами)»